一、 行业背景:
1、行业简介:
医药行业是我国国民经济的重要组成部分,是传统产业和现代产业相结合。其主要门类包括:化学原料药及制剂、中药材、中药饮片、中成药、抗生素、生物制品、生化药品、放射性药品、医疗器械、卫生材料、制药机械、药用包装材料及医药商业。
2、市场规模:
从行业未来发展趋势来看,中国医药市场容量越来越大,规模将以14%-17%速度增长。随着医药需求和医疗保健体系健全,我国将成为全球药品消费增长最快的地区之一。
由于受新冠疫情对我国制造业开工复工造成的阻碍,2020年第一季度,我国医药制造业增速可能放缓,但由于中医药和生物制药的需求推动,二季度可能实现高速增长,但全年将逐渐趋稳,预计2020年全年将继续保持增长趋势,2020年我国医药行业销售收入将突破3万亿元;预计2025年行业规模超过5.3万亿元。
3、行业政策(规范)解读:
1)、GXP合规全流程:
简单的说,有GLP才能进行非临床研究,有GCP才能进行临床研究,有GMP才可以进行规模化生产,有GSP才可以销售,有GUP才可以在医院使用。
GMP计算机化系统部分条款解读:
第十四条:只有经许可的人员财能进入和使用系统。企业应当采取适当的方式杜绝未经许可的人员进入和使用系统。
第十六条:计算机化系统应当记录输入或确认关键数据人员的身份。只有经授权人员,方可修改已输入的数据。每次修改已输入的关键数据均应当经过批准,并应当记录更改数据的理由。应当根据风险评估的结果,考虑在计算机化系统中建立数据审计跟踪系统,用于记录数据的输入和修改以及系统的使用和变更。一句话总结“系统权限的合规管理需从用户进入系统-》录入数据-》更改数据-》审计追踪进行完整管控才行,任何环节的管理缺失,都将带来质量风险。
——审计需求:上网行为审计,数据库审计,日志审计堡垒机。
第十九条:以电子数据为主数据时,应当满足以下要求:
——存储数据备份需求
(一)为满足质量审计的目的,存储的电子数据应当能够打印成清晰易懂的文件。
(二)必须采用物理或电子方法保证数据的安全,以防止故意或意外的损害。
(三)应当建立数据备份与恢复的操作规程,定期对数据备份,以保存存储的数据供将来调用。备份数据应当存储在另一个单独的、安全的地点,保存时间应当至少满足本规范中关于文件、记录保存时限的要求。
第二十条:企业应当建立应急方案,以便系统出现损坏时启用。应急方案启用的及时性应当与需要使用该方案的紧急程度相关。例如,影响召回产品的相关信息应当能够及时获得。
第二十一条:应当建立系统出现故障或损坏时进行处理的操作规程,必要时对该操作规程的相关内容进行验证。
——第二十和二十一条,关键业务容灾需求。
总的来说,GMP针对信息化方面提出需要展开身份认证、安全审计、数据备份、关键业务容灾、应急预案、风险评估等方面的建设要求。
2)、药品追溯体系要求:
为确保药品的生产、销售和使用过程的可追溯性,确保药品安全,避免有害疫苗等药品安全事件,自2005年至2016年,原国家食药监总局牵头开始建设中国药品电子监管平台,但由于建设成本高和数据安全等问题于2016年中断建设。2018年11月国家药监局下发《国家药监局关于药品信息化追溯体系建设的指导意见》强调,实现药品信息化追溯数据社会公众可自主查验,提升全社会对药品信息化追溯的认知度。
目前制药和售药企业采用三中建设模式:自建平台,采用第三方平台(如阿里),采用国家/官方平台,而我们的主要机会就是客户自建平台的超融合新建+平台安全等保建设需求。
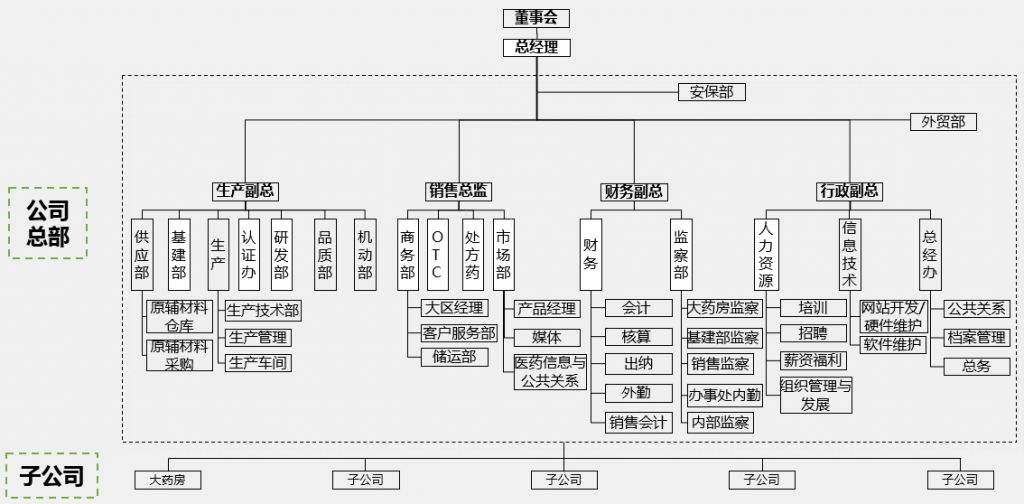
4、行业组织架构:
二、 医药制造行业信息化建设特点:
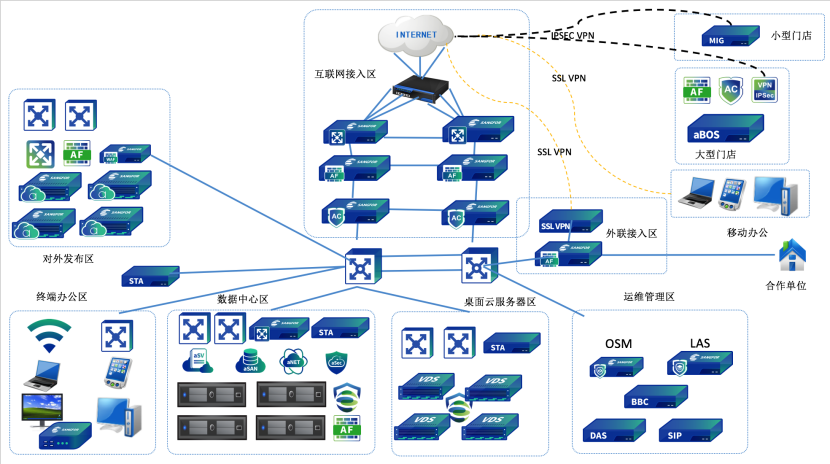
1、 典型网络拓扑:
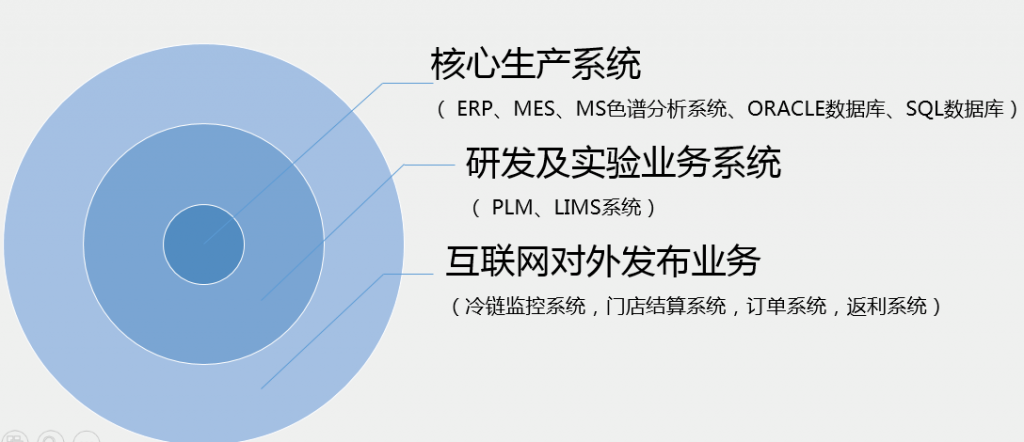
2、 主要业务系统:
制药企业信息化结构是以MES为核心,结合ERP和PLM形成基础架构,在之上搭建QMS覆盖全系统。其中,通过MES集成LIMS、WMS、SCADA&PLC,与ERP、PLM、EMS、EAM进行交互,通过QMS覆盖所有的信息系统,最后通过数据的采集、交互与传递,形成基于质量管理体系的信息生态闭环。
3、 信息化建设趋势:
截止2017年4月,全国通过两化融合资质认证的企业有714家,其中制药企业有30家,这30家制药企业申请评定的新型能力数量为39个,这39个新型能力的建设方向大部分集中在药品质量管控追溯、市场营销、生产过程管控、产品研发、财务成本管控、供应链协同、仓储物流等方面。因此通过两化融合新型能力建设的角度课件,制药行业的信息化建设重点方向和趋势如下:
全面的质量管控与追溯—以GMP为核心,严格执行GMP标准,建立从产品的研发设计、生产制造、质量检验、售后服务的全程质量管理与追溯体系。搭建生产质量监管系统(QMS)、实验室检验系统(LIMS)、生产管理系统(MES)药监码及质量追溯管控系统等;
智能化生产过程管控—2017年工信部、国家食品药品监管总局等六部门发文明确提出到2020年医药生产MES系统使用率达到30%以上,建成一批智能制造示范车间。制药企业采用MES系统将企业管理信息系统与过程控制系统有效整合,对生产数据采集、传输与处理,产品质量跟踪与动态成品控制,在线质量监控与管理,实施在线优化调度与成本管理等功能,实现产品制造过程的全程跟踪;
产品研发创新—通过建立设计研发一体化集成管理平台,实现项目、流程、产品数据、工艺数据的协同管理,不断完善企业研发和工艺管理体系,基于提供的创新协同工作环境,提高企业研发过程管理效率,增强企业产品竞争优势;
快速响应市场—通过实施销售与分销系统,客户关系管理系统(CRM),加强客户关系管理,规范市场运作,加强销售渠道管理,拉近经销商与企业的合作管理,提升销售服务水平;
精细化成本控制—建立完善的成本核算体系,以产品为主线,全面核算企业采购、生产、存储、运输、销售等环节的实际成本,寻找成本波动的规律以持续改善管理效能;
高效的仓储物流—近几年,很多制药企业已经实现了生产系统自动化,但实现仓储物流自动化的相对较少。制药企业应当充分利用信息技术,打造既满足业务需求又符合药品监管机构要求的自动化仓储系统,结合立体仓库、堆垛机、WMS等的应用,实现企业高效、快速、低差错的物资流转。
铭冠网安医药行业勒索病毒防护解决方案需求背景:
2018年8月,大型制造业台积电在装设新机台时,因没有按照操作流程,遭受WannaCry的变种病毒感染。8月3日晚,台积电位于台湾新竹科学园区的12英寸晶圆厂和营运总部,突然传出电脑遭病毒入侵且生产线全数停摆的消息。几个小时之内,台积电位于台中科学园区的Fab 15厂,以及台南科学园区的Fab 14厂也陆续传出同样消息,这代表台积电在台湾北、中、南三处重要生产基地,同步因为病毒入侵而导致生产线停摆。如何有效防御勒索病毒,如何最大化减小安全事件影响范围,如何最快恢复业务,成为制造行业非常重视的问题。
铭冠网安医药行业勒索病毒防护解决方案需求分析:
1、生产网与办公网之间缺少边界防护措施,外部威胁容易进入,安全风险容易在全网扩散;
2、整个生产网络互联,一旦某个区域遭受病毒木马攻击,将扩散至其他区域系统当中;
3、各生产条线均部署有一定的服务器和操作工作站,缺少终端安全管控和病毒防护措施,补丁修复不及时,漏洞隐患严重;
4、内外部人员的U盘可以随意在系统上插入,外部的威胁可以比较容易的带入到生产网络或办公网络中,甚至会导致病毒在生产网/办公网的持续大范围扩散。
铭冠网安医药行业勒索病毒防护解决方案:
1、采用SIP+EDR+AF+IP-guard的立体防护解决方案。
2、直接部署终端检测响应平台EDR;
典型案例:
上海恒瑞医药有限公司、山东新华制药、天津药业集团